Aplikasi Redoks dalam Kehidupan Sehari-hari
MATERI
REDOKS (REDUKSI DAN OKSIDASI)
A.
PENDAHULUAN
Reaksi redoks adalah suatu
reaksi yang didalamnya terjadi oksidasi dan reduksi. Konsep reaksi redoks
terdiri dari tiga:
1) Oksidasi dan reduksi sebagai pengikatan dan
pelepasan oksigen.
2) Oksidasi dan reduksi sebagai pelepasan dan
penerimaan elektron.
3) Oksidasi dan reduksi sebagai pertambahan
dan penurunan bilangan oksidasi.
B.
REAKSI REDOKS BERHUBUNGAN DENGAN OKSIGEN
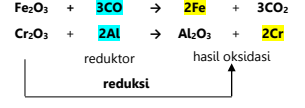
Oksidasi adalah pengikatan oksigen.
Reduksi adalah pelepasan oksigen.
Menurut konsep ini:
1. Oksidasi
adalah reaksi dimana suatu zat direaksikan dengan sumber oksigen sehingga
berikatan dengan oksigen tersebut (membentuk oksida).
2. Reduksi
adalah reaksi dimana suatu zat berupa oksida direaksikan dengan zat yang menarik
oksigen sehingga oksida tersebut kehilangan oksigen.
Oksidator
adalah sumber oksigen yang mengoksidasi zat lain dan tereduksi.
Reduktor
adalah penarik oksigen yang mereduksi zat lain dan teroksidasi.
Contoh
oksidasi menurut konsep ini:
Karena
konsep yang sempit, tidak seluruh reaksi oksidasi/reduksi terjadi secara
simultan (redoks). Tidak seluruh reaksi oksidasi melibatkan reduksi, dan tidak
seluruh reaksi reduksi melibatkan oksidasi.
C.
REAKSI REDOKS BERHUBUNGAN DENGAN ELEKTRON
Oksidasi adalah pelepasan elektron.
Reduksi adalah penerimaan elektron.
Menurut konsep ini:
1) Oksidasi adalah semua proses reaksi
kimia yang disertai pelepasan elektron.
2) Reduksi adalah semua proses reaksi
kimia yang disertai penerimaan elektron.
Oksidator adalah penerima elektron dan
tereduksi.
Reduktor adalah pelepas elektron dan
teroksidasi.
Berdasarkan konsep ini, seluruh reaksi
oksidasi/reduksi terjadi secara simultan karena tiap ada zat yang melepas
elektron, ada pula zat yang menerima elektron. Oleh karena itu, tiap reaksi
oksidasi atau reaksi reduksi menurut konsep ini adalah reaksi redoks. Setengah
reaksi redoks adalah reaksi reduksi atau reaksi oksidasi saja dalam suatu
keseluruhan reaksi redoks.
Contoh
reaksi redoks: Reaksi redoks pembentukan magnesium klorida terjadi menurut
reaksi:
D.
BILANGAN OKSIDASI
Bilangan
oksidasi senyawa adalah jumlah muatan listrik yang dimiliki atom-atom suatu
senyawa, dimana elektron ikatan didistribusikan ke atom yang lebih elektronegatif.
Bilangan
oksidasi atom adalah muatan listrik yang dimiliki suatu atom dalam sebuah
senyawa. Contoh: biloks HCl adalah 0, biloks Mg2+ adalah +2, dan
biloks F - adalah -1.
Penentuan
bilangan oksidasi/biloks atom:
1. Unsur
bebas di alam memiliki biloks 0. Contoh: H2, N2, O2,
P4, S8, Fe, Mn, Ca.
2. Ion
memiliki biloks yang sama dengan nilai muatannya. Contoh: ion CO32-
memiliki biloks -2, ion Ca2+ memiliki biloks +2.
3. Unsur
logam memiliki biloks positif. Nilai-nilai biloks logam:
4. Unsur
fluor (F) selalu memiliki biloks -1.
5. Unsur
hidrogen (H) memiliki biloks:
a. Biloks umum H adalah +1.
Contoh: dalam HCl dan H2SO4,
biloks H adalah +1.
b. Pada hidrida logam, H memiliki biloks -1.
Contoh: Dalam NaH, biloks hidrogen -1.
6. Unsur
oksigen (O) memiliki biloks:
a.
Pada senyawa oksida atau umum, oksigen memiliki biloks -2.
Senyawa
oksida mengandung ion oksida (O2- ).
Contoh:
Pada K2O, H2O, Na2O dan MgO, biloks oksigen
-2.
b.
Pada senyawa peroksida, oksigen memiliki biloks -1.
Senyawa
peroksida mengandung ion peroksida (O2 2- ).
Contoh:
Pada K2O2, H2O2, Na2O2
dan MgO2, biloks oksigen -1.
c.
Pada senyawa superoksida, oksigen memiliki biloks - 1 /2.
Senyawa
superoksida mengandung ion superoksida (O2 - ).
Contoh:
Pada KO2, HO2, NaO2 dan MgO, biloks oksigen -
1 /2.
d.
Pada senyawa F2O, oksigen memiliki biloks +2.
7. Total
biloks atom penyusun suatu senyawa:
a.
Pada senyawa netral, total biloks atom penyusun adalah 0.
b.
Pada senyawa ion, total biloks atom penyusun sama dengan muatan ionnya.
Contoh:
Tentukan bilangan oksidasi unsur S pada Na2SO4!
Jawab:
Biloks Na = +1, biloks O = -2.
Total biloks menjadi: 2(b.o. Na) + (b.o. S) + 4(b.o. O) = 0 2(1) + b.o. S + 4(-2) = 0 b.o. S = 8 – 2 = 6
E.
PENYETARAAN REAKSI REDOKS
Setelah mampu mengindikasi suatu reaksi
oksidasi-reduksi, selanjutnya diperlukan pengetahuan tentang cara menyetarakan
reaksi oksidasi reduksi. Seperti halnya reaksi kimia umumnya, untuk
menyetarakan reaksi oksidasi-reduksi haruslah memenuhi kesetimbangan massa,
yaitu jumlah setiap element/atom harus sama antara kedua sisi. Khusus untuk
reaksi oksidasi-reduksi, ketika kita akan menyetarakannya, terdapat suatu
aturan tambahan, yaitu jumlah elektron yang terlibat selama reaksi, baik yang
dilepas oleh agen pereduksi maupun yang diterima oleh agen pengoksidasi
haruslah sama. Ada dua cara untuk menyetarakan reaksi, yaitu:
a. Metode Setengah Reaksi
b. Metode Bilangan Oksidasi
§ Penyetaraan
Persamaan Reaksi Redoks Penyetaraan persamaan reaksi dengan menggunakan konsep
reaksi reduksi dan oksidasi dilakukan karena banyak reaksi yang sulit
disetarakan dengan cara menebak seperti pada kebanyakan reaksi sederhana. Cara
penyetaraan persamaan reaksi redoks dapat dilakukan dengan dua cara, yaitu cara
setengah reaksi (ion elektron) dan cara perubahan bilangan oksidasi (metode
bilangan oksidasi).
a.
Cara Setengah Reaksi (Ion Elektron) Cara ini didasarkan pada pengertian
bahwa jumlah elektron yang dilepaskan pada setengah reaksi oksidasi sama dengan
jumlah elektron yang diserap pada setengah reaksi reduksi. Penyetaraan
dilakukan dengan menyamakan jumlah elektronnya. Cara ini diutamakan untuk
reaksi dengan suasana reaksi yang telah diketahui. Penyetaraan dalam larutan
bersuasana asam berbeda dengan suasana basa. Proses penyetaraan dengan cara
setengan reaksi mengikuti tahaptahap sebagai berikut :
Tahap
1 : Menuliskan setengah reaksi reduksi dan setengah reaksi oksidasi secara
terpisah dalam bentuk reaksi ion.
Tahap
2 : Menyetarakan jumlah unsur yang mengalami perubahan biloks (biasanya unsur
selain H dan O)
Tahap
3 : Menyetarakan jumlah atom oksigen dengan menambahkan molekul H2O sebanyak
jumlah atom O yang kurang.
· Jika suasana
asam: tambahkan molekul H2O pada ruas yang kekurangan atom O.
· Jika suasana
basa: tambahkan molekul H2O pada ruas yang kelebihan atom O.
Tahap
4 : Menyetarakan jumlah atom hidrogen dengan cara : · Jika suasana asam: dengan menambahkan ion
H+ .
· Jika suasana
basa: dengan menambahkan ion OH– .
Tahap
5 : Menyetarakan muatan dengan menambahkan elektron.
Tahap
6 : Menyamakan jumlah elektron yang diterima pada reaksi reduksi dengan jumlah
elektron yang dilepaskan pada reaksi oksidasi. Jumlahkan kedua setengah reaksi
menjadi satu reaksi redoks yang utuh dan setara.
b. Metode Bilangan Oksidasi
Cara penyetaraan persamaan reaksi dengan
cara perubahan bilangan oksidasi, yaitu dengan cara melihat perubahan bilangan
oksidasinya. Penyetaraan dilakukan dengan menyamakan perubahan bilangan
oksidasi. Pada cara ini suasana reaksi tidak begitu mempengaruhi, meskipun
suasana reaksi belum diketahui, penyetaraan dapat dilakukan. Langkah-langkah
penyetaraan reaksi dengan metode biloks yaitu :
Tahap 1 : Tentukan biloks masing-masing
unsur yang mengalami perubahan biloks.
Tahap
2 : Setarakan unsur yang mengalami perubahan biloks.
Tahap
3 : Tentukan perubahan biloks.
Tahap
4 : Samakan kedua perubahan biloks .
Tahap
5 : Tentukan jumlah muatan di ruas kiri dan di ruas kanan.
Tahap
6 : Setarakan muatan dengan cara:
· Jika muatan di
sebelah kiri lebih negatif, maka ditambahkan ion H+ . Ini berarti
reaksi dengan suasana asam.
·
Jika muatan di sebelah kiri lebih positif, maka ditambahkan ion OH-
. Ini berarti reaksi dengan suasana basa.
Tahap
7 : Setarakan hidrogen dengan menambahkan H2O.
F.
REAKSI REDOKS DALAM KEHIDUPAN SEHARI-HARI
1. Zat pemutih
Zat pemutih adalah senyawa yang dapat
digunakan untuk menghilangkan warna benda, seperti pada tekstil, rambut dan
kertas. Penghilangan warna terjadi melalui reaksi oksidasi. Oksidator yang
biasa digunakan adalah natrium hipoklorit (NaOCl) dan hidrogen peroksida (H2O2).
Warna
benda ditimbulkan oleh elektron yang diaktivasi oleh sinar tampak. Hilangnya
warna benda disebabkan oksidator mampu menghilangkan elektron tersebut.
Elektron yang dilepaskan kemudian diikat oleh oksidator.
2. Fotosintesis
Fotosintesis adalah proses reaksi
oksidasi-reduksi biologi yang terjadi secara alami. Fotosintesis merupakan
proses yang kompleks dan melibatkan tumbuhan hijau, alga hijau atau bakteri
tertentu. Organisme ini mampu menggunakan energi dalam cahaya matahari (cahaya
ultraviolet) melalui reaksi redoks menghasilkan oksigen dan gula.
3. Baterai
Nikel Kadmium
Baterai nikel-kadmium merupakan jenis
baterai yang dapat diisi ulang seperti aki,baterai HP, dll. Anoda yang
digunakan adalah kadmium, katodanya adalah nikel danelektrolitnya adalah KOH.
Reaksi yang terjadi:
anoda
: Cd + 2OH-→Cd(OH)2+ 2e
katoda
: NiO(OH) + H2O→Ni(OH)2+ OH-
Potensial
sel yang dihasilkan sebesar 1,4 volt.
4. Baterai
alkali
Baterai alkali hampir sama dengan bateri
karbon-seng. Anoda dan katodanya samadengan baterai karbon-seng, seng sebagai
anoda dan MnO2 sebagai katoda.Perbedaannya terletak pada jenis
elektrolit yang digunakan. Elektrolit pada bateraialkali adalah KOH atau NaOH.
Reaksi yang terjadi adalah:
anoda:
Zn + 2 OH-→ZnO + H2O + 2e
katoda:
2MnO2+ H2O + 2e-→Mn2O3+
2OH-
Potensial
sel yang dihasilkan baterai alkali 1,54 volt. Arus dan tegangan padabaterai
alkali lebih stabil dibanding baterai karbon-seng.
5. Baterai perak oksida
Bentuk
baterai ini kecil seperti kancing baju biasa digunakan untuk baterai
arloji,kalkulator, dan alat elektronik lainnya. Anoda yang digunakan adalah
seng,katodanya adalah perak oksida dan elektrolitnya adalah KOH. Reaksi yang
terjadi:
anoda
: Zn→Zn2++ 2 e-
katoda
: Ag2O + H2O + 2e→2Ag + 2 OH-
Potensial
sel yang dihasilkan sebesar 1,5 volt.
6. Pada
perkaratan besi
Pada
peristiwa perkaratan (korosi), logam mengalami oksidasi, sedangkan oksigen
(udara) mengalami reduksi.
ANSWER
of QUESTION
·
Jelaskan proses
yang terjadi pada gambar tersebut!
Pada fotosintesis dan respirasi, transfer elektron tidaklah
sederhana. Satu tahap reaksi tetapi melibatkan pembawa elektron yang membawa
elektron dari satu pengantara ke yang lainnya. Dua pembawa elektron yang paling
umum adalah nicotinamide adenine dinucleotide (NAD)
dan nicotinamide adenine dinucleotide phosphate (NADP). Peran dari pembawa elektron ini
dalam reaksi redox dapat digambarkan oleh satu reaksi pada respirasi. Pada
reaksi ini, asam malat teroksidasi menjadi asam oksaloasetat. Setengah reaksi
untuk oksidasi malat adalah :
malat → oksaloasetat + 2e– +
2H+
Elektron yang ditarik dari malat ditransfer ke NAD+,
bentuk teroksidasi dari NAD, dengan demikian mereduksi NAD+ menjadi
NADH.
Reduksi dari NAD+ ditunjukkan oleh setengah reaksi
yang kedua :
NAD+ + 2e– +
2H+ → NADH + H+
Kombinasi dari kedua reaksi diatas :
malat + NAD+ →
oksaloasetat + NADH + H+
NADH adalah agen pereduksi yang kuat yang dapat dipakai untuk
mereduksi molekul yang lain dimanapun didalam sel.
Pada kebanyakan kasus, kehilangan sebuah elektron (e–)
dibarengi dengan kehilangan ion hidrogen atau proton (H+). Dengan
cara yang sama, ketika sebuah molekul tereduksi maka normalnya ia akan
menerima sebuah proton untuk menyeimbangkan muatan negatif dari elektron yang
diperoleh dan menjaga muatan netral. Akan tetapi, untuk NAD+, karena ia mulai dengan muatan
positif, menerima 2 elektron tetapi hanya 1 proton. Dalam kasus ini, proton
kedua bergabung dengan kelompok proton yang ada pada sitoplasma.
Tahap Fotosintesis:
·
Tuliskan persamaan
reaksinya!
Oksidasi:
12H2O → 6O2 + 24H+ +4e-
Reduksi:
6CO2 + 24H+ +4e- → C6H12O
|
·
Tentukan oksidator
dan reduktornya!
Oksidator: CO2
Reduktor: H2O
·
Jelaskan proses
yang terjadi pada gambar tersebut!
Proses pemutihan dilakukan dengan 2 proses, yaitu
meningkatkan efektifitas kerja surfaktan dengan memperkecil ukuran molekul
kotoran dengan mengoksidasinya dan elektron yang dilepaskan kemudian diikat
oleh oksidator. Oksidator yang digunakan biasanya NaOCl. Jika
dilarutkan dalam air, NaOCl akan terurai menjadi
ion Na+ dan OCl-. Ion OCl- akan tereduksi menjadi ion klorin
dan ion hidroksida.
OCl- + 2e- + H2O → Cl- + 2OH-
Biloks
Cl dalam OCl- adalah +1, sedangkan biloks Cl- adalah -1. Berarti Cl
mengalami reduksi atau bertindak sebagai oksidator. Sifat oksidator inilah yang
menyebabkan NaOCl dapat mengoksidasi nda pada pakaian putih.
Proses kedua adalah mengubah warna kotoran menjadi
putih sehingga tidak tampak oleh mata.
·
Tuliskan persamaan
rekasinya!
OCl- + H2O + 2e- → Cl- + 2OH-
·
Tentukan oksidator
dan reduktornya!
Oksidator:
OCl-
Reduktor:
H2O
·
Tentukan biloks
setiap atom yang mengalami redoks!
Biloks
Cl dalam OCl- : 1
Biloks
Cl-:-1
Bilok
H dalam H2O: -1
Biloks
H dalam OH- :1
·
Jelaskan proses yang
terjadi pada gambar!
Pada peristiwa korosi,
logam mengalami oksidasi, sedangkan oksigen (udara) mengalami reduksi. Karat
logam umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi adalah
Fe2O3.nH2O, suatu zat padat yang berwarna
coklat-merah. Korosi merupakan
proses elektrokimia. Pada korosi besi, bagian tertentu dari
besi itu berlaku sebagai anode, di mana besi mengalami oksidasi. Elektron yang
dibebaskan di anode mengalir ke bagian lain dari besi itu yang bertindak
sebagai katode,
di mana oksigen tereduksi. Ion
besi(II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion
besi(III) yang kemudian membentuk senyawa oksida terhidrasi, yaitu karat besi.
Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana
yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat
pengotor, atau perbedaan rapatan logam itu.
·
Tuliskan persamaan
reaksinya!
Persamaan reaksi yang
terjadi
Anoda: Fe(s) → Fe2+(aq) + 2e
Katoda: O2(g) + 2H2O(l) + 2e → 4OH-(aq)
Reaksi Total pembentukan karat: 4Fe(s) + 3O2(g) + nH2O(l) → 2Fe2O3.nH2O(s)
·
Tentukan oksidator
dan reduktornya!
Oksidator:
O2
Reduktor:
Fe
·
Jelaskan proses
yang terjadi pada gambar tersebut!
Sel aki disebut juga sebagai sel penyimpan, karena
dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan. Sel
aki tergolong jenis sel volta sekunder, karena jika zat yang ada di dalam aki
habis, maka dengan mengalirkan arus listrik ke dalam sel aki zat semula akan
terbentuk kembali, sehingga sel aki dapat berfungsi lagi. Sel aki terdiri atas
Pb (timbal) sebagai anode dan PbO2 (timbal dioksida) sebagai katode. Anode dan
katode merupakan zat padat (lempeng) yang berpori, keduanya dicelupkan di dalam
larutan asam sulfat. Aki tidak memerlukan jembatan garam karena hasil reaksinya
tidak larut dalam sulfat. Kedua elektrode disekat dengan bahan fiberglas agar
keduanya tidak saling bersentuhan. Setiap sel aki mempunyai potensial 2 volt.
Jadi, aki 6 volt terdiri 3 sel, aki 12 volt terdiri 6 sel, dan sebagainya.
Masing-masing sel dihubungkan secara seri. Anode
dan katode berubah menjadi zat yang sama yaitu PbSO4. PbSO4 yang terbentuk jika
dibiarkan akan menutup kedua elektrode yang berupa kristal putih. Jika
permukaan kedua elektrode sudah tertutup endapan PbSO4, maka tidak terdapat
selisih potensial, dikatakan aki sudah habis setrumnya. PbO2 di katode dan Pb
di anode berubah menjadi PbSO4. Untuk mengembalikan PbSO4 menjadi Pb dan PbO2,
aki harus dialiri arus listrik. Selama pengosongan aki, H2SO4 diikat dan
dihasilkan air. Dengan demikian kadar H2SO4 berkurang dan massa jenis larutan
berkurang. Aki yang baru diisi
mengandung larutan dengan massa jenis 1,25–1,30 gram/ cm3. Jika massa jenis
larutan turun sampai 1,20 gram/ cm3, aki harus diisi kembali. Pengisian aki
dilakukan dengan membalik arah aliran elektron pada kedua elektrode. Pada
pengosongan aki, anode (Pb) mengirim elektron pada katode; sebaliknya pada
pengisian aki elektrode Pb dihubungkan dengan kutub negatif sumber-sumber arus.
PbSO4 yang terdapat pada anode mengalami reduksi, sedangkan PbSO4 yang terdapat
pada katode mengalami oksidasi membentuk PbO2.
·
Tuliskan persamaan
rekasinya!
Reaksi
penggunaan aki:
Reaksi pengisisan aki:
· Jelaskan proses yang terjadi pada gambar tersebut!
Pada
proses pembakaran ini, terjadi reaksi oksidasi yang terjadi antara propana atau C3H8-
pada udara yang kemudian membentuk CO2. Selain itu atom O2
atau oksigen juga mengalami reaksi reduksi menjadi H2O.
· Tuliskan persamaan reaksinya!
C3H8
(g) + 5 O2 (g) → 3CO2(g) + 4 H2O(g)
·
Tuliskan reaksi
penyetaraan redoksnya!
C3H8
+ O2 → CO2 + H2O
(reaksi belum setara)
Tahap pertama: setarakan jumlah atom C (kiri 3; kanan 1), agar jumlahnya sama
dengan ruas kiri, maka persamaan reaksi menjadi:
C3H8 + O2
→ 3CO2 + H2O
Tahap kedua: setarakan jumlah atom H (kiri 8; kanan 2), agar jumlahnya sama
dengan ruas kiri, maka persamaan reaksi menjadi:
C3H8 + O2 →
3CO2 + 4H2O (4 x 2 atom H pada H2O)
Tahap ketiga: setarakan jumlah atom O (kiri 2; kanan 3 x 2 atom O pada CO2,
dan 4 x 1 atom O pada H2O
sehingga menjadi 10), agar jumlahnya sama dengan ruas kiri, maka persamaan
reaksi menjadi:
C3H8 + 5 O2 →
3CO2 + 4H2O (5 x 2 atom O pada O2)
Dari ketiga tahapan di atas maka dapat ditulis persamaan reaksi setara sebagai
berikut:
C3H8 + 5 O2 → 3CO2 + 4H2O
Terakhir menambahkan wujud dari masing-masing zat, sehingga menjadi:
C3H8(g) + 5 O2(g) → 3CO2(g) + 4H2O
(g)
·
Jelaskan proses
yang terjadi pada gambar tersebut!
Bentuk baterai ini kecil
seperti kancing baju biasa digunakan untuk baterai arloji, kalkulator, dan alat
elektronik lainnya. Anoda yang digunakan adalah seng, katodanya adalah perak
oksida dan elektrolitnya adalah KOH.
·
Tuliskan persamaan
reaksinya!
Zn
+ Ag2O + H2O → Zn(OH)2 +
2Ag+
·
Apakah reaksi
tersebut termasuk reaksi redoks?
Jawaban
: Iya.
Reaksi
yang terjadi :
Anoda :
Zn + 2OH → Zn(OH)2 + 2e
Katoda :
Ag2O + H2O + 2e → 2Ag+ +
2OH
Reaksi
diselnya : Zn + Ag2O + H2O → Zn(OH)2 +
2Ag+
Potensial
sel yang dihasilkan sebesar 1,5 volt.
· Jelaskan proses yang terjadi pada gambar tersebut!
Baterai nikel-kadmium merupakan jenis baterai yang dapat
diisi ulang seperti aki, baterai HP, dll. Anoda yang digunakan adalah kadmium,
katodanya adalah nikel dan elektrolitnya adalah KOH.
·
Tuliskan persamaan
rekasinya!
Cd (s) + NiO2 (s) + 2H2O (l) → Cd(OH)2 (s) + Ni(OH)2 (s)
·
Apakah reaksi
tersebut termasuk reaksi redoks?
Iya.
Anoda : Cd + 2 OH- → Cd(OH)2+ 2e
Katoda : NiO(OH) + H2O → Ni(OH)2+
OH-
Reaksi Sel : Cd (s) + NiO2 (s) + 2H2O (l) → Cd(OH)2 (s) + Ni(OH)2 (s)
Potensial
sel yang dihasilkan sebesar 1,4 volt.
·
Tuliskan persamaan
rekasinya!
KClO₃(s) + S(s) + H⁺(aq) → KCl(s) + SO₂(g) + H₂O(l)
·
Apakah reaksi
tersebut termasuk reaksi redoks?
Iya, proses pembakaran kembang api
termasuk redoks karena terjadi reaksi reduksi
KClO3 dengan berkurangnya bilangan oksidasi atom K dari +7
menjadi +1 dan oksidasi S dengan bertambahnya bilangan oksidasi atom S dari 0
menjadi +4.
·
Tentukan oksidator
dan reduktirnya!
Reduktor = S
Oksidator = KClO₃
·
Tentukan biloks
setiap atom yang mengalami redoks!
Reaktan:
KClO3 = biloks: K= +7, Cl= -1, O= -2(3)= 6
S = biloks: S= 0
Produk:
KCl = biloks: K= +1, Cl= -1
SO2 = biloks: S= +4, O= -2(2)=
-4
·
Jelaskan proses
yang terjadi pada gambar tersebut!
Prinsip
kerja proses penyepuhan adalah penggunaan sel
dengan elektrolit larutan
dan elektrode reaktif.
Contohnya, jika logam atau
cincin dari besi
akan dilapisi emas, digunakan larutan elektrolit
AuCl3(aq). Logam besi (Fe) dijadikan sebagai
katode, sedangkan logam emasnya (Au) sebagai anode. Proses yang
terjadi adalah oksidasi logam emas (anode) menjadi ion Au3+(aq). Kation ini akan
bergerak ke katode
menggantikan kation Au3+ yang direduksi
di katode. Kation Au3+ di katode direduksi
membentuk endapan logam emas yang melapisi logam atau cincin besi
·
Tuliskan persamaan
rekasinya!
AuCl3(aq) → Au3+(aq) + 3Cl-(aq)
Emas (Anode): Au(s) → Au3+(aq) + 3e-(Oksidasi)
Cincin (Katode): Au3+(aq) + 3e- → Au(s) (Reduksi)
·
Apakah reaksi
tersebut termasuk reaksi redoks?
Iya. Proses penyepuhan menggunakan reaksi
elektrolisis di mana jika elektroda yang digunakan tidak inert, maka ia ikut
bereaksi.
·
Jelaskan proses
yang terjadi pada gambar tersebut!
Dinamakan
baterai alkalin karena elektrolitnya bersifat alkali atau basa, bukan asam.
Nama alkalin diambil dari bahan kimia yang digunakan dalam baterai, yaitu:
elektrolit basa kalium klorida. Seperti elektrolit dalam sel kering, bentuknya
bukan cairan, sehingga mudah dibawa-bawa. Komponen
Anoda
: elektroda, bisa berupa logam maupun penghantar listrik lain, pada sel
elektrokimia yang terpolarisasi jika arus listrik mengalir ke dalamnya. Arus
listrik mengalir berlawanan dengan arah pergerakan elektron. Pada proses
elektrokimia, baik sel galvanik (baterai) maupun sel elektrolisis, anoda
mengalami oksidasi. Katoda: Kebalikan dari anoda, katoda adalah elektroda dalam
sel elaktrokimia yang terpolarisasi jika arus listrik mengalir keluar darinya.
Pada baterai biasa (Baterai Karbon-Seng), yang menjadi katoda adalah seng, yang
juga menjadi pembungkus baterai. Sedangkan, pada baterai alkalin, yang menjadi
katoda adalah mangan dioksida (MnO2). Baterai Alkalin
menggunakan potasium Hydroxide (KOH) sebagai elektrolit, selama proses
pengosongan (Discharging) dan pengisian (Charging) dari sel baterai alkali
secara praktis tidak ada perubahan berat jenis cairan elektrolit. Fungsi utama
cairan elektrolit pada baterai alkalin adalah konduktor untuk memindahkan
ion-ion hydroxida dari satu elektroda ke elektroda lainnya tergantung pada
prosesnya, pengosongan atau pengisian,sedangkan selama proses pengisian dan
pengosongan komposisi kimia material aktif pelat-pelat baterai akan berubah.
Proses discharge pada sel berlangsung . Bila sel dihubungkan dengan beban maka,
elektron mengalir dari anoda melalui beban ke katoda, kemudian ion-ion negatif
mengalir ke anoda dan ion-ion positif mengalir ke katoda. Arus listrik dapat
mengalir disebabkan adanya elektron yang bergerak ke dan atau dari elektroda
sel melalui reaksi ion antara molekul elektroda dengan molekul elektrolit
sehingga memberikan jalan bagi elektron untuk mengalir. Pada proses pengisian.
Bila sel dihubungkan dengan power supply maka elektroda positif menjadi anoda
dan elektroda negatif menjadi katoda.
·
Tuliskan persamaan
rekasinya!
Katoda
(+) : 2NH4+(aq) + 2MnO2(s)+ 2e- → Mn2O3(s) +
2NH3(aq) + H2O(l)
Anoda
(-) : Zn(s) → Zn2+(aq) + 2e-
Reaksi
Sel : 2NH4+(aq)
+ 2MnO2(s) + Zn(s) → Mn2O3(s) + 2NH3(aq) + H2O(l) + Zn2+(aq)
·
Tuliskan reaksi
penyetaraan redoksnya!
NH4+ + MnO2 + Zn → Mn2O3
+ NH3 + Zn2+
(suasana basa: muatan reaktan lebih banyak dari
produk)
§
NH4+ →
NH3 + H+
§
2MnO2 → Mn2O3
+ H2O
§
Zn → Zn2+ + 2e-
§
NH4+ →
NH3 + H+
§
2MnO2 + 2H+ → Mn2O3 + H2O
§
Zn → Zn2+ + 2e-
§
NH4+ →
NH3 + H+
§
2MnO2 + 2H+ + 2OH- → Mn2O3
+ H2O + 2OH-
§
Zn → Zn2+ + 2e-
§
NH4+ →
NH3 + H+ |x2|
§
2MnO2 + 2H+ + 2OH- +2e- → Mn2O3 + H2O + 2OH-
§
Zn → Zn2+ + 2e-
Reaksi
setara:
2NH4+
→ 2NH3 + 2H+
2MnO2
+ 2H+ + 2OH- +2e-
→ Mn2O3 + H2O +
2OH-
Zn → Zn2+ + 2e-
2NH4+ + 2MnO2
+ 2H+ + 2OH- + Zn + 2e- →
2NH3 + 2H+ + Mn2O3 +
H2O + 2OH- + Zn2+ + 2e-
2NH4+ + 2MnO2
+ Zn → 2NH3 + Mn2O3
+ H2O + Zn2+
·
Tentukan oksidator
dan reduktornya!
Oksidator:
MnO2
Reduktor:
Zn
·
Tentukan biloks
setiap atom yang mengalami redoks!
Reaktan:
MnO2 = biloks: Mn= +4, O= -2(2)= -4
Zn = biloks: Zn= 0
Produk:
Mn2O3 = biloks: Mn=
+3(2)= +6, O= -2(3)= -6
Zn2+ = biloks: Zn2+=
+2
Daftar
Referensi
Adhiningtias,
Sarah. 15 Februari 2015. Redoks Baterai
Alkali. Prezi.com. Diakses tanggal 11 Oktober 2020 23.28 WIB https://prezi.com/u5zki17hh6nz/redoks-baterai-alkali/
Brown, T.L. dan LeMay, H.E. 1991. Chemistry-The Central Science. Fifth. New Jersey USA: Prentice-Hall, Inc.
Hopkins,
WG. 2006. Photosynthesis and Respiration.
New York: Chelsea House publisher
Johari, J.M.C. dan Rachmawati,
M. Chemistry 3A. s.l. 2011. PT. Penerbit Erlangga.
Pranoto,
Ratna. 2018. Laporan Penelitian Proses
Penyepuhan Emas. docplayer.info. Diakses tanggal 11 Oktober 2020 22.59 WIB https://docplayer.info/69465130-Laporan-penelitian-proses-penyepuhan-emas.html
Rahayu, I. Praktis Belajar Kimia. s.l. 2009. PT.
Visindo Media Persada.
Utami, B. dkk. Kimia Untuk SMA dan MA Kelas XII. s.l.
2009. Pusat Perbukuan.
Zumdahl, S.S. Chemistry. Second. 1989. USA: D.C. Heath and Company.



















Komentar
Posting Komentar